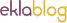-
Le ver géant des abysses
« Riftia Pachyptila », le ver géant des Abysses
peut atteindre 2 m
dépourvu de bouche,
de tube digestif et d'anus,
vivant en symbiose avec des bactéries
vit en l'absence d'énergie solaire
peut vivre pendant 300 ans

(photo :ifremer)
La découverte au printemps 1977 de l'hydrothermalisme océanique profond et de sa faune associée, par 2 600 m de profondeur au niveau de la dorsale océanique des Galápagos, a remis en question en quelques secondes un dogme pourtant bien établi, l'impossibilité de toute vie en l'absence d'énergie solaire. Plusieurs années s'écoulèrent avant que soit identifiée la source d'énergie à la base de l'existence même de ces êtres vivants: l'hydrogène sulfuré, composé mortel pour la plupart des animaux.
Ces organismes sont-ils les vestiges d'un monde perdu ?
Par quelles ruses de la nature peuvent-ils exploiter l'hydrogène sulfuré? L'analyse fine du métabolisme de Riftia pachyptila , ver dépourvu de bouche, de tube digestif et d'anus, vivant en symbiose avec des bactéries, nous entraîne dans les méandres d'un monde moléculaire insolite.
Le 17 septembre 1835, le H.M.S. Beagle , à son bord un jeune naturaliste de 26 ans, Charles Darwin touchait terre sur l'île située au sud-est de l'archipel des Galápagos. Tandis qu'il s'émerveillait de la diversité des pinsons et des nouvelles formes de vie qu'il découvrait, il ne se doutait certainement pas qu'à quelques encablures de là, dans l'obscurité la plus totale des abysses, vivaient des organismes encore plus incroyables. Cent quarante-deux ans plus tard, une mission océanographique dirigée par John Corliss de l'université de l'Etat d'Oregon, découvrit fortuitement des êtres vivants tout à fait étonnants, associés à des émissions hydrothermales par 2 600 m de fond sur la dorsale océanique des Galápagos. Leur découverte restera probablement l'un des événements majeurs de ce siècle dans l'histoire de l'océanographie biologique, car elle bouleversa en quelques instants nos connaissances sur la vie dans les abysses.
De nombreux environnements sur la terre sont considérés comme des déserts, car l'établissement de toute forme de vie y est impossible, sinon réduit, en raison de l'absence de facteurs essentiels comme l'eau, la lumière solaire ou une source de nutriments. Jusqu'en 1977, l'océan profond était considéré comme l'un d'entre eux, avec une biomasse animale de l'ordre de quelques grammes par mètre carré. Toutefois, John Corliss découvrit une étonnante communauté animale qui représentait une biomasse de plusieurs kilogrammes par mètre carré, constituée d'organismes le plus souvent inconnus. Parmi ces animaux, un attira l'attention des biologistes, qu'ils baptisèrent Riftia pachyptila,tube-worm en anglais.
L'intérêt des scientifiques pour cette étrange créature venue des grands fonds était dû non seulement à son abondance et à sa couleur rouge qui tranchait d'une manière spectaculaire avec le noir ébène des basaltes, mais également à sa taille impressionnante. Riftia est un ver tubicole géant pouvant atteindre 2 m de long pour un diamètre de 4 à 5 cm. Il forme des groupes de plusieurs dizaines à plusieurs centaines d'individus, fixés sur le fond à la base des cheminées hydrothermales actives.
La présence d'une telle densité biologique demeura pendant quelques années une véritable énigme. En effet, tous les écosystèmes dépendent de la présence de producteurs primaires de la matière organique qui sera ensuite recyclée tout au long de la chaîne alimentaire. Appelés organismes autotrophes, ils sont capables de synthétiser par fixation de CO2 leurs propres composés carbonés et notamment des hydrates de carbone (les molécules organiques). Les végétaux, qui réalisent cette transformation en utilisant la lumière solaire comme source d'énergie, sont qualifiés de photoautotrophes. Ils sont à la base de la grande majorité des écosystèmes terrestres et aquatiques.
Toutefois, la lumière solaire pénètre seulement jusqu'à 300 ou 400 mètres de profondeur dans cette zone de l'océan (zone euphotique). La vie décroît rapidement avec la profondeur en raison de la faible quantité de matière organique disponible. Généralement, les organismes vivant dans les abysses dépendent de la matière organique provenant de cette zone euphotique. Toutefois, la majorité de cette matière organique est consommée et recyclée avant de parvenir dans les profondeurs, ce qui explique la pauvreté de la biomasse des zones abyssales. Il était donc fort peu probable que ce mécanisme permette la luxuriante biocénose* observée. Les biologistes étaient d'un seul coup confrontés à l'existence d'un monde parallèle indépendant de l'énergie solaire.
Plusieurs années passèrent avant que l'origine de cette biocoenose ne soit découverte. Tout d'abord, les prélèvements d'échantillons de fluides hydrothermaux, effectués par les équipes de John Edmond du Massachusetts Institute of Technology et Karen Von Damm de l'Université du New Hampshire, et leurs collaborateurs, révélèrent la présence de fortes concentrations en hydrogène sulfuré (H2S) autour des animaux. Quel-ques années plus tard, le groupe de Holger Jannasch à l'institut océanographique Woods Hole et celui de David Karl à l'université de Hawaii démontrèrent l'existence de bactéries autotrophes capables d'oxyder H2S dans l'environnement immédiat de ces organismes. Ces bactéries furent baptisées chimiolithoautotrophes parce qu'elles transforment le dioxyde de carbone en molécules organiques, en utilisant non pas l'énergie solaire mais l'énergie chimique de l'oxydation de H2S. Elles étaient à la base de la chaîne alimentaire à l'origine de cet écosystème. Malgré cette découverte, plusieurs questions embarrassantes demeurèrent sans réponse et stimulèrent de nombreuses recherches sur l'adaptation physiologique des organismes aux fortes concentrations en H2S(1) (voir l'enca- dré " Les milieux réduits riches en hydrogène sulfuré "). L'étude anatomique de Riftia révéla l'absence de système digestif, et par conséquent son incapacité à consommer des bactéries autotrophes. On savait par ailleurs que l'hydrogène sulfuré est un dangereux poison: des concentrations de l'ordre de la nanomole ou de la micromole par litre sont suffisantes pour bloquer les processus du métabolisme respiratoire, dit aérobie(2). Dans un tel contexte, comment cet organisme était-il capable de survivre? A l'état adulte, Riftia est en effet dépourvu de bouche, de tube digestif et d'anus.
Comment se nourrit-il ?
Son corps est divisé en quatre régions: l'obturaculum, le vestimentum, le tronc et l'opisthosome. A son extrémité antérieure, la région de l'obturaculum se compose d'une structure centrale rigide ornée de filaments branchiaux. L'ensemble constitue une branchie (ou plume, selon l'appellation anglo-saxonne), un organe d'échange respiratoire très efficace.
D'une couleur rouge vif, elle est directement exposée à l'environnement et peut rentrer intégralement dans le tube de l'animal, si celui-ci est dérangé. Le reste du corps du ver est protégé par un tube souple blanchâtre dont la composition a été élucidée par le groupe de Françoise Gaill de la station biologi-que de Roscoff. Directement sous la branchie se trouve une région musculaire, ou vestimentum, qui contient le coeur, les orifices génitaux et une série de glandes très actives. Cette partie permet au ver de s'ancrer fermement dans la région antérieure de son tube, et de sécréter les nouveaux composants de celui-ci durant sa croissance. Sous le vestimentum, le tronc représente la partie la plus longue de l'animal. Entre deux cavités coelomiques, il contient les gonades et un organe verdâtre qui occupe la majorité de cette région et que l'on nomme trophosome (corps nourricier). Finalement, à l'extrémité postérieure de l'animal se trouve une courte région segmentée, l'opisthosome. Cette région permet au ver de se fixer à la base de son tube et de sécréter la portion basale de ce dernier. Après la description de cet animal et de son anatomie par Meredith Jones du Museum national d'histoire naturelle de Washington D.C., les mécanismes permettant à ce ver de se nourrir restaient toujours énigmatiques.
Par la suite, les études du trophosome réalisées par le groupe de Colleen Cavanaugh à Harvard, indiquèrent la présence de cellules spécialisées contenant des bactéries sulfoxydantes, les bactériocytes. De plus, les travaux biochimiques des groupes de Horst Felbeck à l'institut océanographique Scripps et de James Childress à l'université de Californie à Santa Barbara révélèrent la présence dans ces bactéries d'une enzyme clé de la fixation du carbone chez les organismes autotrophes, la RuBP carboxylase(3,4). Une partie de l'énigme était ainsi résolue. Riftia avait établi une coopération de type endosymbiotique avec les bactéries. Riftia fournissait aux bactéries les éléments inorganiques indispensables à leur métabolisme (oxygène, dioxyde de carbone et hydrogène sulfuré). Il les extrayait de l'environnement au moyen de sa branchie, et les transportait jusqu'aux bactéries par l'intermédiaire de son système circulatoire. En échange il recevait de la part des bactéries des molécules carbonées directement assimilables. A la suite de cette découverte, une nouvelle question se posait: comment Riftia pouvait-il fournir du H2S à ses endosymbiotes sans s'empoisonner?
Tout comme le cyanure, la toxicité de l'hydrogène sulfuré est due à l'inactivation irréversible des métalloprotéines: la cytochrome c oxydase, une enzyme clé du métabolisme aérobie, mais aussi l'hémoglobine. Cette dernière est le transporteur d'oxygène le plus répandu dans le règne animal. Chez les mammifères, elle est contenue dans les globules rouges et leur donne leur couleur. On parle alors d'un pigment respiratoire intracellulaire. Chez d'autres animaux, comme Riftia, l'hémoglobine est dissoute dans le sang, et est donc extracellulaire. Les hémoglobines extracellulaires (EHbs pour Extracellular hemoglobins) de Riftia restaient cependant insensibles à des concentrations en H2S mortelles pour la plupart des organismes et continuaient à assurer leur fonction de transporteur d'oxygène. Riftia avait donc résolu trois problèmes majeurs.
Tout d'abord, il devait posséder un mécanisme particulier pour extraire le H2S de l'environnement et le transporter vers ses bactéries endosymbiotes. Ensuite, le H2S est une molécule hautement réactive et instable. En présence d'oxygène, elle est rapidement oxydée en thiosulfate (S2O32) ou en sulfure élémentaire (S°). Par conséquent, le H2S devait être véhiculé par le système circulatoire tout en évitant d'être oxydé par l'oxygène dissous. De plus, le transport du H2S ne devait pas empêcher celui de l'oxygène par les hémoglobines, c'est-à-dire ne pas entrer en compétition avec l'oxygène pour le site actif de ces molécules, l'hème. Enfin, le transporteur d'hydrogène sulfuré devait lier le H2S avec une très haute affinité, afin d'éviter sa diffusion à travers les membranes cellulaires et l'empoisonnement du métabolisme aérobie dans son ensemble.
Les travaux de James Childress, entre autres, dévoilèrent l'implication essentielle des EHbs de Riftia. En effet, des expériences in vitro ,réalisées en même temps sur les hémoglobines et la cytochrome c oxydase de Riftia, montraient que les EHbs se combinaient avec une très forte affinité au H2S, évitant ainsi l'empoisonnement de la chaîne respiratoire. Par la suite, Alissa Arp et Charles Fisher qui étaient à l'époque dans l'équipe de Childress montrèrent que les EHbs de Riftia étaient capables de lier simultanément et réversiblement, sur deux sites différents, l'oxygène et l'hydrogène sulfuré. Les EHbs avaient un double rôle: elles protégeaient, d'une part, Riftia contre les effets toxiques du H2S par sa fixation sous une forme stable et, d'autre part, elles permettaient à ce composé d'être transporté jusqu'au trophosome et aux bactériocytes sans qu'il soit oxydé.
L'analyse des hémoglobines extracellulaires de Riftia nous a permis de montrer une originalité de ces molécules: la présence de résidus cystéines libres. Ces derniers sont les seuls acides aminés possédant un groupement soufré terminal. Celui-ci se lie généralement à un autre groupe soufré pour former un pont disulfure. Isolé, il peut lier l'hydrogène sulfuré, et donc participer aux mécanismes moléculaires de la liaison du H2S par les EHbs de Riftia. Après la fixation de l'hydrogène sulfuré sur les hémoglobines, sa libération serait provoquée par une acidification du sang dans les capillaires en contact avec les bactériocytes. Cette acidification serait due à la libération de protons résultant entre autre de l'oxydation du H2S par les bactéries. Nous avons identifié la présence de cystéines libres sur d'autres EHbs appartenant à des annélides* colonisant eux aussi des milieux réduits. Les cystéines de leurs EHbs étaient également capables de lier l'hydrogène sulfuré. Cependant, les deux espèces étudiées, Arenicola marina et Alvinella pompejana, n'établissaient pas de relation endosymbiotique avec des bactéries sulfoxydantes. La fonction d'un tel mécanisme devait donc résider exclusivement dans un processus de détoxication, et non dans un phénomène de transport du H2S. Des fonctions de transport et de détoxication, laquelle des deux était apparue en premier et à quel moment?
L'hydrogène sulfuré est un composé chimique très ancien qui était probablement présent sur notre planète avant même l'apparition de la vie, ainsi que dans l'océan primitif, en raison d'une importante activité volcanique. Il est vraisemblable que dans un tel environnement, l'hémoglobine extracellulaire originelle ait possédé les deux fonctions de transport de l'oxygène et de détoxication du H2S. Cette dernière, associée à la présence de cystéines libres, subsisterait actuellement sur les EHbs appartenant à des espèces d'annélides colonisant des milieux riches en H2S. Inutilisée chez d'autres espèces vivant dans des milieux non réduits, cette capacité aurait disparu, et leurs EHbs auraient perdu leurs cystéines libres comme c'est le cas chez Macrobdella decora (annélide achète), Lumbricus terrestris (annélide oligochète) ouTylorrhynchusheterochaetus (annélide polychète).
Le fait de trouver des EHbs en dou- ble hexagone chez tous ces organismes, excepté chez les pogonophores, nous permet d'envisager la présence de ce type de molécule chez un ancêtre commun. La plus ancienne famille d'annélides connue à ce jour date d'environ 700 millions d'années. Par ailleurs, l'équipe de Moris Goodman de l'université d'État Wayne dans le Michigan a montré, en étudiant les homologies entre les chaînes de globines a et b de vertébrés, que ces chaînes avaient divergé par duplication d'un gène ancestral, il y a environ 450 millions d'années.
Si l'on considère les homologies existant entre les chaînes de globines d'oligochètes, de polychètes, de pogonophores et de vestimentifères, qui varient entre 30 % et 80 %, nous avons proposé récemment en référence aux travaux de Goodman que tous ces groupes aient divergé il y a approximativement 450 millions d'années, d'un ancêtre commun annélidien apparu au Précambrien supérieur.
Il semble improbable que la capacité de transporter le H2S ait existé primitivement et persisté chez Riftia et d'autres organismes apparentés (vestimentifères et pogonophores), et soit apparue indépendamment pour évoluer en mécanisme de détoxication chez les annélides. Le mécanisme de détoxication présent initialement chez l'ancêtre commun aurait donc évolué en mécanisme de transport, parallèlement à l'apparition de la symbiose avec des bactéries chimiolithoautotrophes. Plusieurs éléments viennent conforter cette hypothèse. Tout d'abord, le stade larvaire des pogonophores et des vestimentifères est en tout point similaire à celui des annélides. La larve est dépourvue d'endosymbiotes et possède un tube digestif fonctionnel. Deuxièmement, la symbiose peut être considérée comme un caractère évolué qui n'a pu se mettre en place qu'en plusieurs étapes. Troisièmement, la découverte de dépôts hydrothermaux fossilisés contenant des formes de vestimentifères qui dataient du Paléozoïque et du Mésozoïque (570-98 Ma), soit environ 200 à 600 Ma après l'apparition du premier annélide polychète. Quatrièmement, selon un scénario crédible, l'hémoglobine aurait été à l'origine une protéine servant à piéger et à neutraliser l'oxygène toxique au métabolisme des bactéries strictement anaérobies* de l'époque, comme en témoignent encore aujourd'hui les hémoglobines de certains vers (les nématodes).
Ce n'est que par la suite que cette fonction de détoxication aurait évolué vers une fonction de transport de l'oxygène, avec la généralisation du métabolisme aérobie et l'apparition de grands organismes pluricellulaires. Enfin, des molécules de EHbs de petite taille (V2 et C1 chezRiftia), mais dont la composition reste très proche de celle des EHb HBL (V1), seraient apparues après la divergence des annélides avec les vestimentifères et les pogonophores. Après quoi, les pogonophores auraient perdu la possibilité de former des EHbs en double hexagone et n'auraient conservé que les petites EHbs. C'est sur la base de ces considérations que nous avons proposé de regrouper vestimentifères et pogonophores au sein d'une nouvelle classe d'annélides, les opisthochètes. Ce nom fait référence à une caractéristique morphologique commune aux vestimentifères et aux pogonophores, à savoir la présence de soies sur l'opisthosome.
Quelle pourrait être l'origine de cette faune si particulière des fonds hydrothermaux?
Est-elle apparue localement, ou s'agit-il d'espèces exogènes qui auraient migré ultérieurement? Sur les 464 nouvelles espèces colonisant les sources hydrothermales profondes qui ont été décrites à ce jour, 82 % d'entre elles n'ont été observées que dans ce type de milieu. Elles appartiennent à des ensembles taxinomiques très larges (ordre ou embranchement, par exemple), et non à des groupes diversifiés en de multiples genres ou espèces. C'est pourquoi il a été avancé que cette faune ne serait pas le reflet d'une population primitive. Elle aurait trouvé tardivement refuge au niveau de cet écosystème, et n'aurait pas eu le temps d'évoluer pour former des groupes plus variés. Toutefois, une revue détaillée des différents groupes taxinomiques a révélé qu'ils avaient des origines très diverses. De nombreux groupes ont en effet une origine récente, tandis que d'autres seraient plus anciens et auraient survécu aux différentes catastrophes naturelles en se réfugiant dans l'océan profond ou dans des biotopes* riches en H2S.
Il est généralement admis qu'en milieu marin, l'émergence de groupes taxinomiques larges se produit en zone côtière ou sur le plateau continental plutôt qu'en zone abyssale, et ce n'est que par la suite qu'ils migrent vers le talus continental et la zone abyssale. Cette zone dite bathyale (entre 500 et 3 000 m) est souvent considérée comme la zone marine dont les conditions physico-chimiques ont très peu varié au cours des temps géologiques, échappant aux variations du niveau de la mer et de l'influence des zones anoxiques qui seraient apparues dans l'océan profond au Mésozoïque et au Cénozoïque. Néanmoins, le concept de spéciation dans l'océan profond ne peut être totalement éliminé, en raison de la découverte d'animaux appartenant à des familles ou des super familles très proches d'organismes qui ont été découverts à l'état de fossiles datant du Mésozoïque ou de l'ère tertiaire, incluant des espèces appartenant aux groupes des crinoïdes, des mollusques lamellibranches et gastéropodes, des crustacés, des bryozoaires et des brachiopodes.
Certains organismes colonisant les sources hydrothermales profondes ont ainsi une origine très ancienne et présentent des caractères primitifs très marqués. Il n'y a aucune raison de penser qu'il s'agit d'organismes récemment immigrés et qui ont rapidement évolué sur ces sites. Ces espèces reliques apparues au Paléozoïque et au Mésozoïque (entre 500 et 100 millions d'années environ) appartiennent respectivement aux groupes des mollusques gastéropodes et des crustacés cirripèdes. Par conséquent, ces organismes représentent-ils une anomalie dans une faune abyssale plus contemporaine? Le débat reste ouvert.
Verena Tunnicliffe de l'université Victoria au Canada a émis l'hypothèse de l'existence d'une faune profonde strictement inféodée à des biotopes riches en hydrogène sulfuré et qui aurait subi in situ une longue évolution. Il est vrai que l'océan profond semble abriter des organismes strictement inféodés à des zones riches en H2S, comme les sources hydrothermales profondes, les zones de suintements froids, les carcasses de grands mammifères ou encore les épaves de navires chargés en éléments organiques subissant une décomposition bactérienne anaérobie. De plus, la présence de H2S a probablement joué le rôle d'une barrière physiologique dans la colonisation de ces milieux réduits. En effet, bien que les zones de suintements froids soient, par de nombreux aspects, similaires aux sources hydrothermales profondes, ce milieu est moins contraignant et par conséquent plus facilement accessible à la colonisation par des espèces venant de milieux divers, comme en témoigne le plus faible pourcentage d'endémicité comparativement aux sources hydrothermales profondes.
Il est cependant impossible d'écarter l'hypothèse d'une colonisation plus tardive. En effet, en dépit de sa toxicité, le H2S est un composé chimique très fréquemment présent dans les sédiments des zones littorales et de nombreux organismes ont dû s'adapter à sa présence en développant des mécanismes physiologiques (voir l'encadré ci-dessus). Par conséquent, les organismes qui colonisent actuellement les sources hydrothermales profondes ont eu tout le temps d'être pré-adaptés à coloniser cet environnement extrême. On peut trouver par exemple des espèces d'annélides polychètes appartenant au genre Nereis à la fois dans les zones littorales riches en hydrogène sulfuré et en milieu hydrothermal profond.
Enfin, on a longtemps cru que les relations endosymbiotiques entre des bactéries sulfoxydantes et certains invertébrés étaient un caractère spécifique aux sources hydrothermales profondes. Mais ce type de relation symbiotique a pu apparaître dans d'autres milieux réduits plus stables. Il aurait permis par la suite à certains organismes la colonisation de biotopes plus drastiques comme les sources hydrothermales profondes et les zones de suintements froids. L'un des arguments en faveur de cette théorie réside notamment dans la découverte d'un annélide oligochète marin littoral, Phallodrilus leukodermatus. Il colonise des sédiments contenant des concentrations en H2S variant entre 50 et 200 micromoles par litre. Les travaux de Olav Giere de l'institut zoologique de l'université de Hambourg ont montré que cet annélide était tout comme les vestimentifères dépourvu de tube digestif et qu'il avait développé des relations endosymbiotiques avec des bactéries chimiosynthétiques sulfoxydantes.
L'apparition de mécanismes physiologiques permettant à des organismes de tolérer ou d'utiliser le H2S comme source d'énergie a été probablement l'un des facteurs essentiels permettant la colonisation des fonds abyssaux, évitant ainsi l'extinction de certains groupes zoologiques. Elle a été rendue possible par l'évolution des hémoglobines extracellulaires appartenant aux annélides au sens large (incluant les vestimentifères et les pogonophores) vis-à-vis de l'hydrogène sulfuré: de la fonction de détoxication vers une fonction de détoxication et de transport. Dans ce contexte, les hémoglobines ont assuré un rôle essentiel de médiateur entre l'environnement et le milieu intérieur des organismes.
UN VER DES ABYSSES EN AQUARIUM
Durant près de vingt ans, l'équipe de James Childress s'est attachée à étudier les mécanismes physiologiques particuliers de Riftia pachyptila. Ces travaux étaient jusqu'à présent principalement conduits en mer dans des enceintes pressurisées spécialement conçues à cet effet. De tels aquariums permettent de reconstituer les paramètres physico-chimiques des sources hydrothermales profondes. Le système conçu et réalisé par l'équipe de James Childress est constitué d'une pompe capable de fournir une pression de 250 atmosphères (pression rencontrée à 2 500 m), d'une enceinte haute pression et d'une colonne permettant de réaliser le mélange gazeux indispensable à la vie de ces animaux (H2S, CO2, O2) et d'y injecter du NO32. Ce système a été utilisé en mer avec succès pendant plus de dix ans, au cours d'expéditions océanographiques menées sur les dorsales océaniques. Au cours de cette période, Childress et ses collaborateurs ont tenté, à plusieurs reprises, de ramener ces animaux au laboratoire. Néanmoins, il n'avait jamais été possible de les conserver à terre.
De récents progrès techniques et surtout une meilleure connaissance de la physiologie de ce ver marin ont enfin permis de le maintenir en vie pendant plus de deux mois au laboratoire.
En décembre dernier, durant la mission océanographique Hot Times' 97 conduite sur la dorsale du Pacifique oriental, trente Riftia de 10 à 15 cm de long ont été prélevés par 2 600 mètres de fond par le sous-marin américain Alvin et placés à bord du navire dans une enceinte haute pression. L'ensemble du système était maintenu à 15 ûC dans une chambre froide.
Après l'arrivée à San Diego, le 25 décembre 1997, le système a été fermé en conservant une pression de 250 atmosphères à l'intérieur de l'enceinte, placé dans de la glace et ramené au laboratoire. L'ensemble du système fut alors remis en circulation, et au bout d'une journée les conditions nécessaires à la survie de ces animaux étaient stables.
Pendant plus de deux mois, les animaux semblaient en excellente forme, comme en témoignaient la croissance de leur tube ou la couleur rouge vif de leurs branchies. Malheureusement, durant l'une des plus fortes tempêtes ayant affecté la Californie en février dernier, due au phénomène El Ni-o, le réservoir d'eau de mer alimentant les laboratoires fut contaminé par de l'eau douce et des eaux de drainage. Deux jours plus tard, tous les animaux étaient rentrés dans leurs tubes, pour mourir quelque temps après.
LES MILIEUX RÉDUITS RICHES EN HYDROGÈNE SULFURÉ
L'environnement hydrothermal profond est l'un des milieux les plus hostiles que l'on connaisse. Les fluides hydrothermaux sont caractérisés par des températures élevées d'environ 300 °C à 400 °C, de fortes concentrations en éléments réduits tels que l'H2S (jusqu'à 10 mM), des ions métalliques et une forte acidité (pH de 2.0 à 5.9). C'est à l'interface fluide/eau de mer, où les conditions du milieu sont très pauvres en oxygène, agressives et où elles fluctuent rapidement que l'on observe ces communautés animales luxuriantes basées sur la chimiosynthèse bactérienne. Dans cet écosystème, la flore bactérienne est diversifiée. Sa densité avoisine ou dépasse celle des eaux littorales de surface. En dehors des zones hydrothermales, il existe de nombreux biotopes caractérisés par de fortes concentrations en H2S. Les sédiments marins, les zones côtières envasées, les estuaires ou encore les zones d'émissaires urbains, sont généralement pauvres en oxygène, dès les premiers centimètres sous l'interface eau-sédiment. La concentration de H2S peut atteindre plusieurs millimoles par litre dans certaines zones littorales. Dans ces environnements, la présence de H2S est essentiellement due à la dégradation anaérobie de la matière organique et à l'action des bactéries sulfato-réductrices présentes dans les sédiments. Ainsi, la vie en présence de concentrations diverses en sulfure semble être un caractère commun à de nombreux organismes aquatiques benthiques (vivant sur le fond).
Bien que l'hydrogène sulfuré des sources hydrothermales soit d'origine géothermique et que dans les sédiments il soit d'origine biologique, l'environnement chimique des deux habitats est très semblable. Cependant, à proximité des sources hydrothermales, le H2S est localisé dans la colonne d'eau, alors que dans les sédiments il se trouve au sein même du substrat. Ainsi, contrairement aux organismes hydrothermaux, de nombreux organismes vivant dans les sédiments peuvent s'affranchir des sulfures en irriguant leurs galeries ou par le biais d'organes d'échanges sortant du sédiment pour entrer en contact avec une eau moins soufrée.
LES HÉMOGLOBINES EXTRA-CELLULAIRES DE RIFTIA PACHYPTILA
L'équipe de François Lallier, dans laquelle j'ai réalisé une grande partie de mes travaux, s'est intéressée à l'identification des mécanismes impliqués dans la liaison réversible de l'hydrogène sulfuré par les EHbs de Riftia , dans une perspective d'écophysiologie moléculaire. La stratégie adoptée a consisté à comparer les structures moléculaires de EHbs appartenant à des organismes proches de Riftia (annélides et vestimentifères) colonisant des milieux réduits (riches en H2S), avec des structures d'EHbs provenant d'annélides colonisant des milieux non réduits. Riftia possède trois EHbs différentes, deux EHbs dissoutes dans le compartiment vasculaire (V1 et V2) et une dissoute dans le compartiment coelomique*(C1). V1 est un biopolymère géant de masse moléculaire d'environ 3 500 kilodalton (kDa), alors que la masse moléculaire des hémoglobines intracellulaires des vertébrés est d'environ 64 kDa.
En microscopie électronique, le EHb V1 a l'aspect d'un double hexagone (hexagonal-bilayer ou HBL selon la terminologie anglo-saxonne) de 30 nm de diamètre, formé de deux fois six unités globulaires, les douzièmes, disposées en deux anneaux superposés. Chaque molécule est constituée d'environ 200 chaînes poly- peptidiques appartenant à 6 ou 7 types différents que l'on regroupe en deux catégories. La première correspond à des chaînes dites fonctionnelles portant le site actif des hémoglobines (l'hème), de masse comprise entre 15 et 18 kDa. La deuxième correspond à des chaînes polypeptidiques dites de structure possédant peu ou pas de site actif mais permettant l'assemblage des douzièmes, de masse comprise entre 22 et 27 kDa.
Les molécules V2 et C1 sont dépourvues de chaînes de structure et ont une masse moléculaire d'environ 400 kDa. Le modèle que nous avons proposé pour le EHb V1 comporte 144 chaînes de type fonctionnel et 36 chaînes de type structure. De la même façon, V2 et C1 sont construites par l'assemblage de 24 chaînes polypeptidiques de type globine. (source : larecherche)
Ver des abysses en aquarium. Cette créature mystérieuse de 2 mètres se nourrit de gaz.
Par HUET Sylvestre
«C'est la chance du débutant», s'amuse Franck Zal. Le jeune
biologiste, passé directement de sa thèse à Jussieu au laboratoire de biologie marine de l'université de Californie à Santa Barbara est tout excité devant l'aquarium pour le moins singulier inventé par James Childress, le directeur du labo. Le cylindre en métal hyperrésistant de un mètre vingt de long pour trente centimètres de diamètre, percé de hublots, contient une eau sous 300 bars de pression, celle qui règne par 3 000 mètres de fond, dans les océans. Il y injecte en permanence des gaz CO2, sulfure d'hydrogène, azote à des concentrations mortelles pour le commun des animaux. Cet étrange bocal est pourtant le lieu de vie, depuis la fin décembre, de bestioles extraordinaires que l'on ne pouvait observer vivantes, jusqu'à présent, qu'en plongeant dans les abysses.
C'est d'ailleurs ce que Franck Zal a fait, le 27 novembre 1997. Il inaugure alors une série de 22 plongées, à bord de l'Alvin, le sous-marin de recherche américain, en plein coeur du Pacifique oriental, au large du Mexique, par 9,5° Nord. Objectif: la dorsale océanique, une longue faille nord-sud à partir de laquelle se forme le plancher de l'océan. Par 3000 mètres de fond, la faille est piquetée de «fumeurs» des minigeysers d'où s'échappe une eau brûlante et lourdement chargée en minéraux et métaux toxiques. Découverte il y a vingt ans seulement, dans ces grands fonds que l'on pensait stériles, une faune extraordinaire vit de ce brouet brûlant et empoisonné. Une faune totalement déconnectée de la biosphère terrestre et marine, fondée sur la photosynthèse à partir de l'énergie solaire.
On y trouve des bactéries, des sortes de crabes, de crevettes" et surtout ces vers géants les Riftia pachyptila qui peuvent atteindre 2 mètres de long pour 4 à 5 centimètres de diamètre. A l'abri d'un tube en chitine construit à une vitesse sans égale, il se nourrit" un peu comme nous respirons. Dépourvu d'organes de digestion, il vit grâce à une symbiose avec des bactéries qu'il alimente en hydrogène sulfuré. Ce gaz, il le prélève dans l'eau par l'intermédiaire des molécules d'hémoglobine et de ses branchies, exactement comme nous prélevons l'oxygène de l'air dans nos poumons. Toute sa biochimie relève du même «bricolage évolutif» et excite les biologistes qui, depuis des années, tentaient de les étudier en labo.
Lors des plongées de l'Alvin, Franck Zal et ses collègues ont prélevé 40 jeunes vers. «Ils font environ 15 cm, mais des mesures au fond montrent qu'ils peuvent croître jusqu'à 80 cm par an.» Costauds, ils ont tous survécu au transport, à la décompression/recompression lors du prélèvement" et Franck Zal espère même voir naître des larves. «Nous avons repéré des mâles et des femelles, affirme-t-il. Et nous savons qu'ils se reproduisent en rejetant leurs gamètes dans l'eau. Mais tout le reste du cycle, l'implantation des larves et le démarrage de la symbiose avec les bactéries nous est inconnu.».
(source : liberation)
"La source de nos informations est indiquée pour chaque parution, mais au cas où l'auteur de vidéos, articles ou photos souhaiterait ne plus les voir figurer sur le site, qu'il nous en avertisse par mail, et nous les retirerons immédiatement"
Entre science et conscience